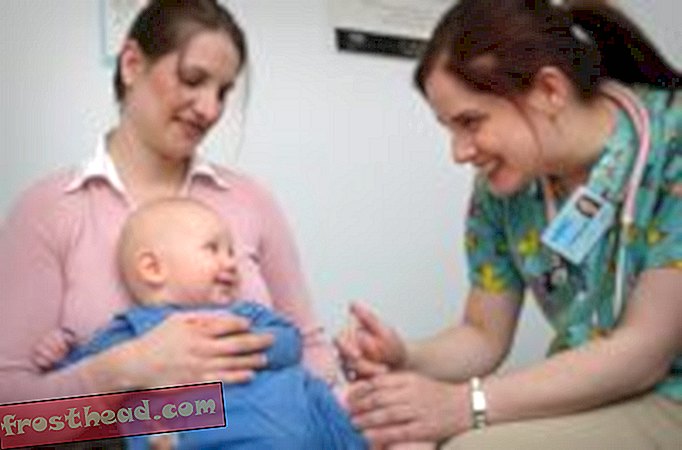
O pequeno espaço sem janelas do Hospital Infantil da Filadélfia parece com qualquer sala de exames de oftalmologistas, com uma cadeira ajustável e meia dúzia de máquinas para testar a visão. O paciente de 20 anos, no entanto, não veio de Albuquerque para comprar novos óculos. Alisha Bacoccini, que tem cabelos curtos, loiros e olhos verdes, nasceu com um distúrbio causado por um gene defeituoso em suas células da retina que vem diminuindo sua visão desde o nascimento. Agora ela vê apenas formas pálidas e embaçadas. "Se eu olhar para você, não consigo ver a cor dos olhos, a acne ou as sobrancelhas, mas vejo que alguém está lá", diz ela. Seu cão-olho, Tundra, um labrador preto, senta-se a seus pés.
Desta história
[×] FECHAR
Dois dos pesquisadores mais proeminentes da terapia genética esperam melhorar a visão de seus pacientes em uma operação experimental
Vídeo: Especialistas em Terapia Gênica Anticiparão o Tratamento da Cegueira
Conteúdo Relacionado
- Playlists de música para acalmar sua mente
- Grandes esperanças para um novo tipo de gene
Um mês antes, em um tratamento experimental, pesquisadores injetaram o olho direito de Bacoccini - o pior - com bilhões de cópias de trabalho do gene da célula da retina. Agora eles descobrirão se o tratamento funcionou.
Jean Bennett, médico e geneticista molecular, tem Bacoccini descansando a testa contra uma pequena máquina branca que acende a luz em um olho, depois o outro. Este pupilômetro indicará quão bem os olhos de Bacoccini respondem à luz. "OK, um, dois, três, abra", diz Bennett, e repete o procedimento 16 vezes. Em uma tela de computador na sala escura, as pupilas de Bacoccini são dois círculos negros gigantes que se contraem levemente com cada pulso de luz. Outro pesquisador acompanha o Bacoccini até o próximo aparato de testes. Meia hora depois, Bennett diz: "Eu apenas olhei para os resultados da sua pupilometria. Boa melhora."
"Isso é bom", diz Bacoccini, embora pareça insegura. Desde alguns dias após a injeção, ela realmente viu mais luz do olho, diz ela, mas as coisas parecem mais confusas. Quando ela tenta ler uma carta de olho gigante com o olho direito, ela não faz nada melhor do que antes - ela pode escolher apenas algumas letras de cinco centímetros de altura. Então, novamente, o olho dela ainda está vermelho da cirurgia. O marido de Bennett, Albert Maguire, é o cirurgião de retina que operou com Bacoccini. Ele olha nos olhos dela e diz que a superfície ainda não cicatrizou, acrescentando: "Espero que seja só isso."
A perspectiva de usar terapia genética para tratar doenças - particularmente doenças hereditárias que envolvem um gene errante, como anemia falciforme e fibrose cística - tem atormentado cientistas há décadas. Se houvesse alguma maneira de dar ao paciente uma boa versão de um gene implicado, repensa-se o raciocínio, ele poderia consertar ou prevenir danos causados pelo mau herdado. Esta ideia aparentemente simples revelou-se inesperadamente complexa na prática. Houve centenas de testes de terapia genética humana para muitas doenças, desde a hemofilia ao câncer, nos últimos 18 anos. Mas quase todos falharam devido às dificuldades de se obter um gene funcional nas células sem causar efeitos colaterais prejudiciais.
Até o ano passado, a terapia genética havia funcionado inequivocamente contra apenas uma doença, a afecção rara chamada de imunodeficiência combinada severa (SCID), que é causada por uma falha em qualquer um dos vários genes necessários para produzir glóbulos brancos. A doença deixa o sistema imunológico incapaz de combater infecções e geralmente leva à morte na infância. É também chamado de doença "boy bubble", depois de um famoso paciente, David Vetter, que viveu até 12 anos em uma bolha de plástico estéril. Desde meados da década de 1990, pesquisadores europeus curaram cerca de 30 crianças com SCID, inserindo o gene apropriado em sua medula óssea. Mas mesmo esse sucesso foi misturado com a tragédia: cinco das crianças desenvolveram leucemia e uma morreu. Naqueles pacientes, que tinham uma variante específica da doença, o gene terapêutico acidentalmente ligou um gene causador de câncer após a fusão com o DNA dos pacientes. Os pesquisadores agora estão testando maneiras de tornar a terapia genética para SCID mais segura.
A pesquisa sobre terapia gênica nos EUA sofreu um retrocesso substancial depois que Jesse Gelsinger, de 18 anos, que sofria de uma doença hepática hereditária, morreu de falência múltipla de órgãos em 1999 enquanto participava de um experimento de terapia gênica na Universidade da Pensilvânia. Notícias da morte provocaram um alvoroço na comunidade científica e audiências no Congresso, com o pai do adolescente, Paul Gelsinger, e outros acusando os pesquisadores da Penn de serem muito apressados para testar o tratamento em pessoas. Segundo a Food and Drug Administration, os pesquisadores não haviam alertado suficientemente Gelsinger e sua família sobre os riscos do experimento. O pesquisador-chefe também não revelou que tinha participação financeira em uma empresa que poderia ganhar se o tratamento fosse bem-sucedido. "Aqueles foram os dias terríveis. O campo chegou ao fundo", diz Leon Rosenberg, geneticista humano da Universidade de Princeton, que realizou estudos laboratoriais iniciais sobre a doença hepática que Gelsinger tinha. "A integridade da ciência foi tremendamente danificada".
Bennett e Maguire se juntaram ao corpo docente da faculdade de medicina da Penn em 1992. Um de seus colegas é James Wilson, que supervisionou o estudo no qual Gelsinger morreu. Wilson foi posteriormente impedido pela FDA de realizar experimentos em humanos. Mas Bennett e Maguire não estavam envolvidos nesse estudo. Seu teste experimental de terapia genética começou em 2007 após anos de revisão por reguladores federais, o Hospital Infantil e os comitês da Penn criados para tratar de preocupações éticas e de segurança levantadas pela morte de Gelsinger.
Em maio passado, sua equipe e um grupo britânico separado relataram as primeiras notícias promissoras sobre terapia genética em anos: a técnica poderia tratar a cegueira. Os pacientes do estudo tinham uma doença chamada amaurose congênita de Leber (LCA). Os três pacientes tratados por Bennett e Maguire conseguiram ler mais várias linhas de um diagrama de olhos do que antes. Um homem de 26 anos até recuperou a visão suficiente para atravessar um labirinto. "Eu não pude acreditar", diz Bennett. Ela o fez andar pelo labirinto de novo.
O estudo foi pequeno, e os pacientes ainda são legalmente cegos, mas sua melhora modesta e a aparente segurança da terapia despertaram as esperanças de pacientes e pesquisadores em todo o mundo. Agora Bennett e Maguire estão ampliando a pesquisa para mais pacientes com LCA, incluindo Bacoccini, para testar se os pacientes podem receber com segurança doses mais altas do gene terapêutico.
Rosenberg diz que está "encantado" por Bennett - que foi pesquisador de pós-doutorado em seu laboratório em 1987 - e pelo campo. "Estou otimista sobre a terapia genética novamente e não tenho sido por um tempo", diz ele. "Espero que antes do final desta década haja dois ou três outros exemplos."
Tanto para Bennett, 54, quanto para Maguire, 48, a ciência parece estar em seus genes. A mãe de Bennett, Frances, lecionava literatura de ensino médio e seu pai, William, era um professor de física popular em Yale que havia inventado o laser a gás em 1960 enquanto trabalhava na Bell Labs em Nova Jersey. Bennett se lembra de ter 6 anos e ver seu pai voltar ao laboratório depois do jantar para trabalhar até o amanhecer; Posteriormente, o dispositivo levou a leitores de discos compactos e scanners de preços de supermercados.
Ela estava mais interessada em biologia do que física. "Eu amava criaturas", diz ela, e passava muitas horas felizes examinando o microscópio de seu pai na água e nas folhas do pântano. Após a faculdade em Yale, ela foi para a Universidade da Califórnia em Berkeley para obter um doutorado em biologia do desenvolvimento, usando ouriços do mar, mas foi atraída para novas pesquisas sobre a inserção de genes estranhos específicos em camundongos e outros animais - um precursor da terapia de genes. Ela passou vários meses em 1981 e 1983 nos Institutos Nacionais de Saúde em Bethesda, Maryland, em um laboratório onde os cientistas estavam planejando alguns dos primeiros testes de terapia gênica. "Foi um vislumbre que ia acontecer que me deixou animado. Eu queria estar lá enquanto o campo se desenvolvia", lembra Bennett. Para obter o conhecimento clínico necessário, ela foi para a Harvard Medical School, onde conheceu seu futuro marido em uma aula de anatomia no primeiro ano.
Maguire também veio de uma família de cientistas. Seu pai, Henry, era dermatologista e agora é pesquisador de vacinas contra o câncer na Penn, e sua mãe, Elise, trabalhava lá como assistente de pesquisa. Henry tinha catarata e depois descolamento de retina. Quando Maguire estava no ensino médio, ele administrava os colírios do pai - sua primeira incursão no tratamento oftalmológico. Na faculdade de medicina, Maguire trabalhou em um laboratório que estudava doenças da retina causadas por defeitos genéticos hereditários. Ele se lembra de perguntar a Bennett na época se os genes ruins poderiam ser consertados. "Isso faz sentido", ela disse a ele. "Vamos fazer isso."
O olho é especialmente adequado para a terapia genética. As células nas quais um novo gene deve ser inserido são limitadas a uma pequena área; a retina contém apenas alguns milhões de células. Além disso, ao contrário da maioria das células, as células da retina não se dividem depois de uma pessoa ter 3 meses de idade, de modo que os pesquisadores não precisam obter o novo gene nas gerações futuras de células. Isso significa que eles não precisam costurar o novo gene no DNA existente das células, que é replicado quando uma célula se divide. Manter o gene terapêutico separado do DNA do paciente é mais seguro; nos pacientes com SCID que desenvolveram leucemia, o gene introduzido foi incorporado próximo a um gene causador de câncer e acidentalmente ligado. O olho também é imunoprivilegiado, ou seja, o sistema imunológico tende a ignorar o material estranho introduzido lá. Uma resposta imune descontrolada tem sido um problema em alguns testes de terapia genética e é o que matou Jesse Gelsinger. "Temos muita sorte com a escolha do órgão alvo", diz Maguire.
Enquanto Maguire treinava para se tornar uma cirurgiã de retina, Bennett continuou a se especializar em pesquisa, em vez de trabalho clínico, seguindo seu marido em todo o país para seu estágio, residência e companheirismo. Complicando questões, eles estavam viajando com crianças. Em seu último ano de faculdade de medicina, os recém-casados tiveram seu primeiro bebê - "nosso projeto sênior", como eles chamam. Mais dois filhos logo a seguiram.
Em 1989, durante uma das últimas paradas de treinamento de Maguire, em Royal Oaks, Michigan, Bennett instalou laboratórios improvisados no prédio ao lado do hospital e no porão de sua casa. Eles conduziram o que eles acham que foi o primeiro experimento de terapia genética envolvendo a retina. Usando ratos e coelhos, eles injetaram um gene para uma enzima encontrada em bactérias. Eles usaram um corante para revelar se as células do olho tinham construído a enzima e o experimento foi bem-sucedido: as retinas dos animais ficaram azuis por cerca de duas semanas.
Na Penn, eles publicaram um dos dois primeiros artigos mostrando que um vírus dotado de um gene estranho poderia transportá-lo para o tecido ocular, neste caso em camundongos. (Essa estratégia, comum em experimentos de terapia genética, essencialmente coopta a capacidade do vírus de se replicar injetando seu próprio material genético nas células.) Posteriormente, Bennett e Maguire inseriram genes terapêuticos nos olhos de alguns setters irlandeses com cegueira hereditária. Mas Bennett achava que a melhora nos cães não era convincente o suficiente para justificar um teste humano. O que eles precisavam era de uma forma simples e lenta de cegueira que estivesse relacionada a uma doença que aflige as pessoas. Em 1998, eles aprenderam sobre uma raça de cães briard na Suécia com uma doença ocular que, por acaso, foi causada por uma das mutações genéticas encontradas em alguns pacientes com LCA.
Cerca de 3.000 pessoas nos Estados Unidos sofrem de ACV, que engloba vários distúrbios de cegueira diferentes que começam na infância e são causados por mutações em qualquer um dos vários genes, um dos quais é chamado de RPE65. Ele contém as instruções para uma enzima crucial para as células sensíveis à luz da retina, as hastes e cones; a enzima converte a vitamina A em uma forma que os bastonetes e os cones usam para fazer um pigmento necessário, a rodopsina. Nas pessoas que herdam uma cópia ruim do gene RPE65 de cada um dos pais, os cones e bastonetes, desprovidos de rodopsina, funcionam mal e acabam morrendo.
Bennett, Maguire e colaboradores usaram um vírus chamado adeno-associated virus para inserir uma boa cópia do gene RPE65 em três jovens briards. Os dois genes do vírus AAV foram substituídos pelo gene RPE65 mais uma cadeia de DNA que liga o gene. Os cães recuperaram a visão suficiente para navegar em um labirinto. "Foi fantasticamente emocionante", diz Bennett. Um cão, Lancelot, tornou-se um tipo de cão-propaganda para a terapia genética, agitando as patas com as pessoas em conferências de imprensa e captação de recursos.
Na calçada em frente ao escritório, Bennett mostra um dos mais de 50 cães que eles trataram. Vênus, um briard de tamanho médio com cabelos castanhos e crespos, puxa a coleira e claramente gostaria de correr para longe, mas ela se senta para deixar um visitante acariciá-la. "Quando ela veio aqui, ela não podia ver nada. Ela se agachava em um canto ou em uma gaiola mostrando os dentes para as pessoas", diz Bennett. Isso foi há um ano, antes que a equipe de Bennett / Maguire tratasse o paciente de 1 ano de idade em ambos os olhos com terapia gênica. Embora ainda cego à noite, Vênus pode agora saltar sobre obstáculos espalhados ao longo de um corredor e pegar uma bola de tênis. "O comportamento dela foi transformado", diz Bennett. "Ela está vendo bem em ambos os olhos. Ela é um cachorro muito feliz."
Quando eles tentaram o tratamento em pessoas pela primeira vez, Bennett e Maguire não esperavam que seus pacientes melhorassem tanto quanto os cães. Por um lado, os médicos estavam testando a segurança primeiro e usavam doses baixas do vírus e do gene. E seus primeiros pacientes, todos de uma clínica oftalmológica na Itália que testam pacientes cegos quanto a defeitos genéticos, eram gêmeos de 26 anos e 19 anos. Por essa idade, pacientes com LCA não têm muito tecido retiniano à esquerda. A maioria é completamente cega aos 40 anos.
Ainda assim, Bennett e Maguire não sabiam o que esperar quando trataram o primeiro paciente, um dos gêmeos. Ele foi anestesiado, então Maguire fez várias pequenas incisões e substituiu o material vítreo semelhante a gel no olho do homem com uma solução salina para que Maguire pudesse manobrar uma agulha através dela com mais facilidade. Usando um microscópio, ele enfiou uma agulha fina no cabelo através do branco do olho até tocar a retina. Ele injetou 150 microlitros de uma solução (uma gota do tamanho de uma ervilha) que continha 15 bilhões de cópias do vírus AAV com o gene RPE65. O vírus é considerado um mecanismo de entrega extremamente seguro - não pode se replicar sozinho e não causa doenças em humanos.
Mesmo assim, naquela noite "eu não dormi nada", diz Maguire, que estava preocupado com uma reação imunológica. Para seu alívio, não havia nenhum.
Embora a dose fosse baixa, Bennett diz que a primeira vez que ela olhou para os dados de pupilometria do jovem foi "um momento Eureka" - seu olho podia sentir mais luz. Alguns meses depois de receber a terapia experimental, os três pacientes estavam vendo mais luz. Dois que conseguiam ver apenas movimentos da mão antes podiam ler três ou quatro linhas de um diagrama de olhos.
A visão de todos os três pacientes ainda está melhorando, diz Bennett. O jovem de 19 anos, que retornou à Itália, não precisa mais de ajuda para andar à noite.
Quando Alisha Bacoccini nasceu, sua mãe, Eve Skidmore, percebeu imediatamente que algo estava errado. Alisha parecia se concentrar apenas na luz brilhante, como uma janela ou lâmpada, diz Skidmore. Ela achava que a filha só precisaria de óculos, mas o oftalmologista disse que a menina estava ficando cega e nada poderia ser feito. Ela foi diagnosticada com uma doença ocular progressiva aos 11 meses, e um teste genético finalmente identificou a doença como LCA. Quando criança, Alisha ainda podia ver bem o suficiente para jogar futebol com uma bola branca na grama verde. "Ela foi extremamente rápida", diz Skidmore, que compensou não ver a bola no ar. Por volta da oitava série, Alisha perdeu até aquela visão limitada.
Hoje ela pode ler texto em uma tela de computador brilhante, mas não em um livro. Ela trabalha como massoterapeuta. Se ela pudesse enxergar melhor, seu trabalho de sonho seria trabalhar como patologista forense - ela devora romances de Patricia Cornwell em fita. Skidmore deseja que sua filha recupere o suficiente para "ver as estrelas no céu e um arco-íris, porque ela nunca viu isso".
Bacoccini diz que percebe que sua visão pode não melhorar no estudo de terapia genética e pode até piorar. Ela se ofereceu para participar, para que ela pudesse "ajudar a descobrir como consertar a cegueira", diz ela.
Três meses após Maguire injetar nos olhos de Bacoccini os vírus que carregavam o gene da retina, seus olhos eram dez vezes mais sensíveis à luz e sua visão periférica melhorara, mas ela não conseguia ler um diagrama de olhos melhor do que antes. Bennett diz que há várias razões pelas quais o tratamento pode não estar funcionando bem para ela - por exemplo, os circuitos neurais entre o olho e o cérebro de Bacoccini podem não mais funcionar adequadamente.
Bacoccini faz parte de uma segunda fase do estudo que deu a três pacientes com ACV uma dose maior de terapia gênica do que os três primeiros voluntários receberam. Um dos outros pacientes do grupo de Bacoccini é um menino belga de 9 anos de idade, que mostrou algumas das melhorias mais impressionantes até agora. Ele pode ver detalhes de rostos pela primeira vez e não precisa mais de um dispositivo de ampliação especial para ver a lousa na escola. Quanto mais jovem o paciente, Bennett e Maguire acreditam, mais chances o casal tem de reverter a cegueira causada pela ACV. Eventualmente, eles esperam tratar bebês.
A pesquisa biomédica envolve muitas vezes grandes equipes de colaboradores, mas os estudos de terapia genética são um caso extremo. O artigo do ano passado no New England Journal of Medicine, anunciando o sucesso inicial da terapia genética para a cegueira, listou 32 co-autores, dos biólogos moleculares que projetaram o vírus aos médicos italianos que encontraram os pacientes. Bennett, o principal autor, dirige este grupo de um pequeno escritório fora de seu laboratório. O espaço é abarrotado de cadernos e pastas e decorado com fotos em miniatura de seus três filhos, capas de revistas e algumas fotos de Lancelot, agora com 8 anos e ainda vendo bem.
Maguire afirma que seu papel de administrar injeções aos pacientes é menor: "Acabei de carregar os caminhões". Mas ele é, afinal, um dos especialistas clínicos. "Com doenças [herdadas da cegueira], há uma enorme sobreposição emocional", diz ele. "Os médicos sempre os consideram incuráveis e dizem aos pacientes que não há nada que possamos fazer por você. O fato de que isso parece estar funcionando é extremamente excitante."
O sucesso do julgamento da LCA trouxe muita atenção a Bennett e Maguire - "uma quantidade desconfortável de atenção", diz ele - incluindo convites de congressistas para informá-los sobre o trabalho. Mas o duo parece estar no ritmo. Bennett tem recebido meia dúzia de telefonemas e e-mails por dia de pacientes cegos ou de seus pais que ouviram falar do estudo da ACV. "Eu respondo a todos eles. Todas essas pessoas estão muito, muito chateadas por ficarem cegas ou serem cegas", diz ela. Para ter certeza, é improvável que eles se encaixem no teste de ACV porque não têm a falha genética correta. Mas ela diz a eles para serem testados para os genes da cegueira de qualquer maneira, porque um tratamento de terapia genética para sua doença pode surgir dentro de alguns anos.
Em breve, Maguire e Bennett esperam começar experimentos com gatos abissínios com LCA causados por uma mutação genética diferente daquela em que se concentraram até agora. Eles também estão planejando um estudo clínico de terapia genética para uma forma da doença de Stargardt, ou degeneração macular juvenil, que afeta cerca de 25.000 pessoas nos Estados Unidos e que eles trataram com sucesso em ratos projetados para ter a doença. Agora que foi demonstrado que a terapia genética pode ser realizada com segurança no olho, as empresas estão explorando maneiras de usar a técnica para tratar doenças que não são necessariamente de origem genética. Por exemplo, a introdução de um gene que controla o crescimento dos vasos sanguíneos pode retardar a degeneração macular relacionada à idade, que afeta mais de dez milhões de americanos.
Apesar de seus altos sucessos médicos, Bennett e Maguire dirigem para trabalhar em carros de dez anos de idade. Em casa, ela relaxa jardinando e tocando o piano de cauda de sua avó, e ele pinta cenas de fazenda detalhadas em estilo de arte popular - produzindo "cada folha de grama", diz Bennett. ("Há um pequeno transtorno obsessivo-compulsivo", Maguire explica sobre seus hobbies). O filho mais novo foi para a faculdade, mas eles cuidam de dois cachorros, um aquário de peixes e tartarugas e cerca de 15 tentilhões - o último passatempo de Maguire está observando comportamento das aves. A família "tem um alto limiar para a desordem", diz Maguire.
Bennett fica acordado tarde da noite escrevendo relatórios, concedendo inscrições e planejando mais experiências. Ela é tão motivada quanto o pai quando trabalhava no laser a gás. "Há uma excitação incrível que você está prestes a quebrar uma barreira em algo", diz ela.
Jocelyn Kaiser cobre pesquisa e política biomédica para a revista Science .
Stephen Voss fotografou recentemente a degradação ambiental na China. Ambos moram em Washington, DC