Há uma foto de LaDonna Lopossa que ajuda a contar a história. Ela é toda sorrisos, deitada na grama em um jeito vagamente Betty Grable em cima de sua própria trama de cemitério. O retrato era a ideia de seu marido - em suas décadas juntas, parece que George, vulgo Sr. No Serious, nunca viu uma piada de que não gostasse - mas foi LaDonna quem fez a pose de cheesecake.
Conteúdo Relacionado
- Grandes esperanças para um novo tipo de gene
- Os "judeus secretos" do vale de San Luis
"OK", George disse, "agora tire sua camisa".
"George!"
Clique.
Por um lado, é um retrato bobo de uma mulher de 60 anos em um cardigã e sandálias sensatas em Winlock, Washington, um dia ensolarado em maio de 2000. Por outro lado, é um vislumbre de um possível futuro em que a ciência resolveu um problema temível. Pois é assim que LaDonna e George enfrentaram seu câncer letal, não apenas assobiando pelo cemitério, mas fazendo palhaçadas no meio dele.
Três meses antes, LaDonna estava deitado em uma cama de hospital em Olympia prestes a abrir a cortina. Havia muito a esquecer: quatro filhos crescidos, vários netos, amigos na igreja, um bom casamento. (Não importa que enquanto ela estava lá, George estava dizendo em voz alta às enfermeiras que ele ia bater nas barras para encontrar outra esposa, o que ela entendia como seu esforço esquisito para aliviar sua mente.) Ela estava pronta para deixar todos e todas essas coisas e mais por causa da dor.
Seu baço, normalmente enfiado sob a costela esquerda e não maior que um pêssego, estava tão cheio de glóbulos brancos que era do tamanho de um melão. Ela mal podia andar. Sua pele era fantasmagórica, seu sangue perigosamente curto de glóbulos vermelhos. Respirar era uma tarefa. Vômito regular. Esfaquear as dores profundas em seus ossos, onde a medula estava freneticamente produzindo glóbulos brancos ou leucócitos. Febres recorrentes. E frio, estranhamente, enervantemente frio : ela estava congelando sob os cobertores do hospital.
Ela estava muito velha e doente demais para se submeter a um transplante de medula óssea, um tratamento extenuante e altamente arriscado para o câncer no sangue, a leucemia mielóide crônica (LMC). Ela já havia tentado o outro tratamento padrão da CML, doses regulares do composto poderoso interferon. Mas intensificou tanto a náusea, febres e dores ósseas que abandonou a medicação, aconteça o que acontecer. Sem nada restando em seu arsenal de combate à leucemia, os médicos foram até Dilaudid, um derivado da morfina, o analgésico narcótico. Era calmante, reconfortante e, para um paciente em sua condição, era, naturalmente, o fim.
George havia doado a maior parte de seus pertences e reservado uma caminhonete para transportar suas coisas para o sul da Califórnia, onde se mudaria com um de seus filhos. A música para o seu funeral foi escolhida, incluindo “Because I Have Been Much”, para ser cantada pelos netos. Quando o hospital recomendou levar LaDonna a um hospício, George a levou para casa e seguiu o conselho do médico para convocar as crianças; Terry, Darren e Stephen voaram da área de Los Angeles, e Kelly saiu de seu lugar em Winlock. Um a um, eles foram para o quarto, sentaram-se ao lado da cama de LaDonna e se despediram.
A LMC é um dos quatro principais tipos de leucemia em adultos, mas não é comum, atingindo 5.000 pessoas nos Estados Unidos a cada ano. Por via de regra, é fatal, com a maioria de pacientes que morrem dentro de cinco anos do diagnóstico. A primeira fase, uma explosão furtiva de glóbulos brancos normais, pode durar meses ou anos; os pacientes são frequentemente alertados para a condição por meio de um exame de sangue de rotina. Se a doença não for controlada, os glóbulos brancos se tornarão cada vez mais anormais, emitindo células de células-tronco específicas na medula óssea chamadas células mieloides; tais leucócitos estouram os capilares, sobrecarregam os órgãos e sufocam os tecidos, expulsando os glóbulos vermelhos transportadores de oxigénio. O curso da doença é excepcionalmente previsível, dizem os médicos, mas sua natureza mecânica também forneceu aos cientistas uma oportunidade: intrometer-se nas engrenagens moleculares e nas molas que impulsionam a LMC, eles a entendem melhor do que qualquer outro câncer.
Certa vez, no início de dezembro de 1999, George estava dirigindo para ver LaDonna no hospital em Olympia e parou em um Safeway para comprar um jornal. Mr. No Serious é um leitor ávido, até mesmo dirigiu uma livraria com LaDonna, e devorou o jornal em seu quarto de hospital. Por acaso, um tratamento experimental com leucemia estava fazendo manchetes. "A pílula leucêmica é promissora", informou a Associated Press, dizendo que os pacientes com LMC "tinham contagens normais de sangue dentro de um mês após o início do tratamento". O estudo estava em andamento na Oregon Health & Science University (OHSU) em Portland.
George correu para fora do quarto do hospital para encontrar o oncologista de LaDonna.
Meta para Intervenção
Uma estrada íngreme, sinuosa e arborizada leva ao campus principal, que fica situado perto do cume de Marquam Hill, de 574 pés de altura, e em dias de nevoeiro parece flutuar sobre a cidade como um castelo em um conto de fadas. Outra rota até OHSU é o bonde aéreo de Portland: dois teleféricos suíços de aço reluzente sobrevoam cabos acima da Interstate 5, zumbindo as pessoas de um lado para o outro entre a margem oeste do rio Willamette e uma plataforma hospitalar mais perto da borda. de um penhasco do que os pacientes com coração que desembarcam podem desejar que seja.
Brian Druker chegou à OHSU em 1993, anos antes de o bonde ser construído e o mural do hall da fama na passagem adjacente incluiria uma foto dele. Alto, magro e leve como um galgo, de fala mansa, Druker tinha 38 anos e acabara de passar nove anos no Instituto do Câncer Dana-Farber, parte da Harvard Medical School, em Boston. "Eu vi o câncer como um problema tratável", ele lembrou do caminho de pesquisa que escolheu depois de terminar o curso de medicina na Universidade da Califórnia, em San Diego. “As pessoas estavam começando a receber algumas dicas e algumas pistas, e pareceu-me que, em toda a minha vida, era provável que cedesse à ciência e à descoberta”.
No Dana-Farber, Druker aterrou num laboratório a estudar como uma célula humana normal dá origem a um crescimento descontrolado - malignidade. Entre outras coisas, o laboratório se concentrou em enzimas, proteínas que modificam outras moléculas, quebrando-as (enzimas intestinais, por exemplo, ajudam a digerir os alimentos) ou ligando-as (as enzimas do folículo piloso constroem fibras sedosas de queratina). Enzimas também figuram em reações em cadeia, com uma enzima ativando outra e assim por diante, até que alguma façanha celular complexa seja realizada; Assim, uma célula pode controlar um processo como o crescimento ou a divisão, iniciando uma única reação, como derrubar o primeiro dominó. Sob o comando do chefe do laboratório, Thomas Roberts, Druker dominou várias técnicas para rastrear e medir enzimas em amostras de tecido, acabando por se dedicar a uma implicação na LMC.
Trabalhar os detalhes de por que essa enzima em particular é a chave para a CML envolveu centenas de cientistas em todo o mundo - pesquisas que levariam a vários prêmios Nobel -, mas é basicamente aqui que Druker começou:
Primeiro, todos os pacientes com LMC têm a enzima renegada em seus glóbulos brancos.
Segundo, a enzima em si é o produto de um gene esquisito, chamado BCR-ABL, formado durante a divisão de uma única célula-tronco mielóide e depois transmitida a bilhões de descendentes: as pontas de dois cromossomos, aquelas estruturas espigadas que armazenam DNA, trocam de lugar, fazendo com que genes separados chamados BCR e ABL se fundissem (veja a ilustração). O novo gene mutante BCR-ABL está em um cromossomo peculiar descoberto em 1960 por cientistas da Universidade da Pensilvânia. Este "cromossomo Filadélfia", visível através de um microscópio, é a marca registrada da CML.
Terceiro, a enzima BCR-ABL é o gêmeo maligno de uma enzima normal que ajuda a controlar a produção de glóbulos brancos. Mas como um interruptor preso na posição "on", o mutante estimula a proliferação selvagem que é a leucemia.
Você não precisava ser um médico de Harvard para ver que uma única enzima que causa uma leucemia fatal era, como dizem os pesquisadores, um alvo atraente para a intervenção. E, de fato, os cientistas estavam planejando encontrar ou inventar compostos que pudessem bloquear a enzima BCR-ABL.
Druker e seus colegas de Boston, usando anticorpos especialmente desenvolvidos, desenvolveram uma nova maneira de medir a atividade da enzima - uma ferramenta que seria inestimável para avaliar potenciais tratamentos da CML. Um médico que usava gravata entre os PhDs vestidos de jean, Druker estava competindo em outros centros de pesquisa para encontrar uma droga que suprime o câncer, desativando uma enzima crítica e poupando tecidos saudáveis no negócio. Por tradição, os tratamentos contra o câncer bombardearam o corpo com drogas poderosas, matando células saudáveis e cancerosas da mesma forma - "quimioterapia citotóxica", dizem os médicos. A alternativa, a terapia direcionada, combateria melhor o câncer com menos danos colaterais, ou pelo menos essa era a noção de que frequentemente mantinha Druker no laboratório até as onze da noite.
Então as coisas começaram a desmoronar. “Meu casamento foi quebrado. Eu não era o que você chamaria de marido devotado. Eu era um investigador dedicado e cientista e médico. E isso custou caro. ”(Druker e sua esposa se separaram depois de dois anos de casamento e depois se divorciaram.)
Ainda assim, com uma série de estudos publicados e uma técnica bacana de mensuração de enzimas para demonstrar seus esforços, Druker achou que estava pronto para subir na hierarquia de Harvard de instrutor para professor assistente. "Eu me sentei com o chefe de oncologia médica em Dana-Farber", lembrou Druker. “Ele examinou meu currículo e disse: 'Eu não acho que esse trabalho vá a lugar algum'.” Tradução: “Disseram que eu não tinha futuro na Dana-Farber”.
"Foi horrível", lembrou ele. "Eu estava deprimido. Mas isso me forçou a dizer: Eu acredito em mim mesmo? Eu vou fazer isso, fazer a diferença?
Preocupação crescente
Solicitado a descrever a abordagem de Druker, um cientista disse que se resumia a "perseverança e teimosia em não deixar passar uma ideia".
"Eu acho intrinsecamente que ele é uma pessoa tímida", disse outro. “Mas nisso” - terapia de câncer - “ele é como um cruzado”.
"Ele toma tudo o que é complicado, empurra-o em sua mente e produz a mais simples interpretação e intervenção possíveis".
“Quando você faz uma pergunta, há silêncio na sala, silêncio quase desconfortável, e você, tipo, ele me ouviu? Ele pensa sobre as coisas antes de dar uma resposta.
"Ele deixa a ciência falar."
Druker cresceu como o mais novo de quatro filhos em St. Paul, Minnesota, e frequentou escolas públicas, destacando-se em matemática e ciências. Seu pai era químico na 3M, cujo trabalho em processos de impressão foi patenteado. Sua mãe era uma dona de casa que se envolveu na política do conselho escolar e correu sem sucesso para a legislatura estadual. Depois de se formar com um diploma de química da UC San Diego, ele continuou, e em 1978, seu primeiro ano na escola de medicina, escreveu um artigo de 16 páginas sugerindo um futuro que ajudaria a criar. Escrito a mão com tinta azul em papel de caderno e intitulado “Cancer Chemotherapy”, concluiu que, algum dia, quando a ação de drogas contra o câncer for “entendida em termos bioquímicos, o campo da quimioterapia deveria avançar muito além do progresso já feito. "
Depois que o Instituto do Câncer Dana-Farber deu a ele a pressa do vagabundo, Druker conseguiu nova resolução. “Quando me mudei para o Oregon, meu objetivo era identificar uma empresa farmacêutica que tivesse um remédio para a LMC e colocar isso na clínica”, disse ele.
Ele já havia conhecido Nick Lydon, um bioquímico da firma farmacêutica suíça Ciba-Geigy (que se fundiria com a Sandoz em 1996 para formar a Novartis). Lydon havia colaborado com Roberts, ex-chefe de laboratório de Druker. “Liguei para meu amigo Nick na Ciba-Geigy e ele disse: 'Temos o que você está procurando.'” Era chamado STI571. Os químicos da empresa tinham sintetizado e outros compostos enquanto procuravam por um novo medicamento anti-inflamatório, mas eles aprenderam que ele também poderia bloquear a atividade de enzimas em um tubo de ensaio. Ainda assim, eles não tinham decidido o que fazer com o composto.
Em agosto de 1993, Druker recebeu seu primeiro lote de líquido STI571 e outro composto candidato da Suíça. Usando a ferramenta de medição de enzimas que ele ajudou a desenvolver, ele confirmou que o STI571 inibiu fortemente a enzima BCR-ABL, que pertence a uma classe de enzimas conhecidas como tirosina quinases; o outro composto fez isso apenas fracamente. Ele também derramou quantidades mínimas de STI571 em uma bandeja de recipientes do tamanho de um dedal que continha glóbulos brancos fluidos e vivos derivados de um paciente com LMC. Druker esperava que o crescimento das células diminuísse ou parasse. Melhor ainda, as células morreram. Além disso, uma grande quantidade de STI571 administrada a células saudáveis em um prato não causou danos. “A contribuição de Brian foi fundamental”, lembrou Lydon, ao convencer a empresa a “seguir nessa direção”.
Mas, é claro, o caminho para as esperanças frustradas é pavimentado com drogas experimentais que pareciam formidáveis em um tubo de ensaio, mas falharam em seres humanos. Os céticos apontaram que centenas de diferentes tipos de enzimas tirosina quinase atuam no corpo, e, acrescentaram, uma droga que bloqueia uma também bloqueia muitas outras e causa estragos fisiológicos? "Houve muitos pessimistas que argumentaram que seria impossível desenvolver inibidores específicos de proteína-quinase" para o tratamento do câncer, escreveu Tony Hunter, bioquímico do Instituto Salk, em La Jolla, Califórnia, no Journal of Clinical Investigation .
Idéias científicas não criam raízes, como sementes de dente-de-leão flutuando em solo fértil. Eles precisam de defensores, pessoas que querem ganhar . Druker ligou, fazendo mais experimentos, como induzir uma forma de CML em ratos de laboratório e submetê-los ao STI571. Tudo, mas eliminou a doença dos animais. "Eu estava colocando provavelmente 60 a 80 horas por semana", lembrou Druker, que em seu tempo livre escasso competiu em corridas de bicicleta, um esporte que exige uma alta tolerância à dor e uma sensação de quando sair da matilha. “Minha vida naqueles dias era que eu trabalhava [no laboratório], trabalhava, comia e dormia”. O que o estava guiando, ele disse, eram pacientes com LMC que estavam morrendo.
Em 1997, tendo publicado numerosos estudos com colegas de trabalho em Portland e na Suíça, Druker acreditava que o composto estava pronto para ser experimentado em seres humanos. Novartis discordou. Por um lado, quando os cães receberam o medicamento em forma intravenosa, tendeu a causar coágulos sanguíneos no final do cateter. Os químicos da Novartis passaram meses reformulando a droga líquida como uma pílula. Mas quando os pesquisadores deram grandes doses aos cães, os animais mostraram sinais de danos no fígado. Alguns funcionários da empresa, lembrou Druker, aconselharam abandonar completamente o projeto.
Mas o dano no fígado canino não o perturbou; a quimioterapia, afinal, é destrutiva. "Nós sabíamos como dar drogas contra o câncer tóxico", disse ele.
A próxima coisa que Druker fez pode não ter sido ilegal, mas certamente não era kosher. Ele contornou a Novartis e foi direto para a Food and Drug Administration para ver se havia acumulado dados suficientes para iniciar um teste em seres humanos. “Eu chamei o toxicologista do FDA e disse: 'Aqui está o problema.' E ele disse: "Meu Deus, você tem uma tonelada de dados, provavelmente aceitaríamos esse pedido". Druker contou então à Novartis o que ele havia feito. "Eu me meti em um pouco de água quente porque eu fui atrás das costas deles."
Finalmente, em junho de 1998, com a permissão da FDA para prosseguir, Druker administrou o STI571 a um ser humano, um homem de 68 anos de idade, com CML. "Era quase anticlimático", lembrou Druker, "pois estávamos prontos em novembro de 1996 e aqui já passamos um ano e meio".
Ele havia recrutado dois eminentes oncologistas para ajudar no teste clínico, Moshe Talpaz no MD Anderson Cancer Center em Houston e Charles Sawyers na UCLA. Todos os pacientes com LMC recrutados nas três cidades foram submetidos à terapia com interferon e não conseguiram melhorar ou recaíram. Nenhum foi elegível para um transplante de medula óssea.
Aumentando gradualmente a dosagem de STI571, os médicos observaram em cerca de seis meses que a contagem astronômica do sangue branco de quase 100.000 células por milímetro cúbico estava caindo para menos de 10.000, bem dentro do normal. A análise de um dos primeiros glóbulos brancos dos pacientes não encontrou sinais do cromossomo Filadélfia, sugerindo que a leucemia havia sido interrompida na fonte. Mais impressionante, qualquer que fosse o vestígio do gene BCR-ABL que permaneceu, deixou de se copiar. "Foi quando soubemos que tínhamos algo parecido com o que nunca tinha sido visto antes na terapia do câncer", disse Druker.
Quando a notícia se espalhou pela Internet, outros pacientes da CML quiseram entrar. Druker pressionou a Novartis a produzir mais drogas. Mas a Novartis não estava pronta. A droga era difícil de fazer, Daniel Vasella, então diretor executivo da Novartis e agora presidente do conselho, lembraria em seu livro sobre a droga, Magic Cancer Bullet . "Também não era [a droga] uma alta prioridade, dado o pequeno número de pacientes com LMC", acrescentou. Além disso, provar que era seguro e eficaz exigiria um investimento substancial. "Um efeito colateral grave pode se desenvolver em um dos 1.000 pacientes e isso seria o fim do teste", escreveu ele.
Em setembro de 1999, Druker recebeu um e-mail de uma paciente CML de 33 anos em Montreal, Suzan McNamara. Ela estava tomando interferon, que havia suprimido sua doença por quase um ano, mas agora estava rugindo de volta, e ela queria se juntar a um teste STI571. "Eu estava doente a ponto de mal poder sair de casa", ela relembrou para mim.
Druker telefonou para ela no dia seguinte e disse que seriam meses antes que ela pudesse se inscrever em um estudo - a Novartis não se comprometeu a produzir mais STI571. Mas, acrescentou ele, a empresa pode se mover mais rapidamente se ouvir diretamente dos pacientes.
McNamara e um amigo usaram um site na Internet para criar uma petição solicitando que a droga fosse disponibilizada mais amplamente; milhares de pacientes com LMC endossaram isso. Ela enviou-o para Vasella com uma carta dizendo: "Temos visto com crescente preocupação a nossa crença ... de que o fornecimento da droga não foi suficiente para expandir os testes tão rápido quanto a evidência até o momento seria necessária".
"A carta não pode ser ignorada", disse Vasella. A empresa aumentou a produção do STI571.
A honra de anunciar os primeiros resultados clínicos recaiu sobre Druker. Em Nova Orleans, em 3 de dezembro de 1999, ele disse a um auditório cheio de hematologistas que todos os 31 pacientes do estudo responderam favoravelmente ao STI571, com a contagem de glóbulos brancos de 30 caindo para o normal dentro de um mês. Os efeitos colaterais da pílula - dores de estômago, cãibras musculares - foram o que os oncologistas chamam de "leve a moderado". Druker diz que não se lembra da ovação de pé.
As descobertas foram "o sonho de um oncologista molecular que se tornou realidade", escreveu Harold Varmus, que atualmente lidera o Instituto Nacional do Câncer e recebeu o Prêmio Nobel de pesquisa que lançou algumas das bases para o sucesso do STI571. A droga, ele lembra em seu livro de 2009, A arte e a política da ciência, foi "a melhor evidência até hoje de que os aspectos mais fundamentais da pesquisa sobre o câncer tiveram benefícios dramáticos para pacientes com câncer".
A CNN, o New York Times, o “Good Morning America” e a Associated Press cobriram a inovadora pílula anticonvulsiva.
Onda do Futuro
Depois que LaDonna Lopossa e seus filhos se despediram em fevereiro de 2000, ela ficou mais alguns dias e conseguiu uma consulta na OHSU. O oncologista e George de LaDonna conseguiram levá-la para a segunda fase do estudo STI571, que envolveria 500 novos pacientes em uma dúzia de centros médicos em todo o mundo. Ela entrou na clínica no braço de George. "Em que nos metemos?" Uma das enfermeiras disse, significando que a morte de LaDonna, que parecia iminente, contaria como uma marca negra contra a droga. Sua contagem de glóbulos brancos excedeu 200.000, mais de 20 vezes o normal. "Não havia duas maneiras sobre isso", disse Druker. "Você olhou para ela e ela estava em apuros."
Eles a examinaram e deram a ela uma pílula STI571. Ela vomitou.
Na manhã seguinte, George e LaDonna acordaram no apartamento de sua irmã em Portland e George fez a LaDonna um milk-shake de banana. Mais tarde naquele dia, a pílula STI571 ficou para baixo. E o próximo e assim por diante.
"Dentro de três semanas, o baço voltou a ser praticamente normal", disse Druker. “Ela estava se sentindo ótima. A contagem de brancos caíra. Um efeito semelhante a Lázaro. Foi verdadeiramente milagroso.
Foi em maio do mesmo ano que LaDonna e George visitaram o cemitério em Winlock para colocar flores no túmulo de sua mãe, que fica ao lado do enredo que LaDonna havia comprado para si. "Eu deveria estar nessa sepultura", disse ela a George.
"Bem", ele disse, "já que você não está, por que não tiramos uma foto?"
No final do inverno de 2001, Druker e seus colaboradores reuniram grande parte de seus dados do STI571: em cerca de 95% dos pacientes, os níveis de glóbulos brancos voltaram ao normal e, em 60%, o cromossomo Filadélfia não foi detectado. A empresa apresentou os resultados com seu novo pedido de medicamentos à FDA, que aprovou em dois meses e meio - até hoje a revisão de medicamentos mais rápida da história da agência.
Dez anos atrás, o governo dos EUA anunciou que o medicamento, que a Novartis nomeou Gleevec no mercado norte-americano (Glivec na Europa), estaria disponível para pacientes com LMC. Foi um momento decisivo. O século anterior de tratamentos contra o câncer - de sucesso intermitente, baseado em testes de tentativa e erro, quase sempre angustiantes - seria conhecido pelos especialistas como "antes do Gleevec". A partir daí foi "depois do Gleevec", a era da terapia direcionada. Em uma conferência de imprensa em Washington, DC em 10 de maio, o Secretário de Saúde e Serviços Humanos, Tommy Thompson, chamou a droga de um "avanço" e "a onda do futuro". O então diretor do Instituto Nacional do Câncer, Richard Klausner, descreveu-o como "uma imagem do futuro do tratamento do câncer".
Hoje, Suzan McNamara concordaria que o futuro é bom. Quando ela viajou pela primeira vez para Portland em 2000 para participar do estudo da Gleevec, ela se lembrou: “Eu fui lá com metade do meu cabelo e anoréxica, e não pude nem subir um lance de escadas. E voltei em um mês e meio 20 quilos mais pesado e cheio de vida ”. Seus próximos passos foram para a McGill University, estudar terapias com leucemia e obter um PhD em medicina experimental. Agora com 44 anos, ela mora em Montreal e trabalha em Ottawa para a Health Canada, uma agência federal. Ainda no Gleevec, ela corre várias milhas algumas vezes por semana. "Eu iria mais se não fosse tão preguiçoso", ela disse. Em janeiro de 2010, ela se casou com seu namorado de longa data, Derek Tahamont, no Havaí. "Ele ficou ao meu lado durante toda a doença e tudo", disse ela. “Nós decidimos pegar um avião e nos casar em uma praia, só nós dois. Foi perfeito."
O Gleevec encorajou as pessoas a pensarem que o câncer nem sempre é um invasor mortal que deve ser aniquilado, mas uma doença crônica que pode ser controlada, como o diabetes. Em estudos de acompanhamento liderados por Druker, cerca de 90% dos pacientes recém-diagnosticados com LMC que começaram a tomar o Gleevec sobreviveram cinco anos. "Eu digo aos pacientes como estou otimista sobre o futuro deles", disse Druker. “Estamos projetando para o Gleevec que a sobrevivência média será de 30 anos. Alguém diagnosticado com 60 anos pode viver até 90 e morrer de outra coisa.
Quando LaDonna Lopossa tinha 60 anos, ela lembrou, Druker disse que ele a manteria viva até os 70 anos. Então ela alcançou o marco. "Eu quis dizer quando fiz 70 anos", ele brincou com ela então.
LaDonna, agora com 71 anos, e George, 68, moram em Battle Ground, Washington, uma cidade rural a 40 quilômetros ao norte de OHSU, onde LaDonna permanece sob os cuidados de Druker. Os Lopossas moram em um bangalô em um complexo habitacional de terceira idade subsidiado pelo Estado, do outro lado da rua, de uma família que mantém galinhas no quintal e deixa George cultivar ervas. Um anúncio emoldurado para a revista Gleevec, com LaDonna, está pendurado na parede de uma sala de estar. Dois retratos de Cristo enfeitam a parede de uma sala de jantar. George, que é rápido em dizer que não é religioso - "ninguém sabe como era Jesus", brincou com a iconografia de LaDonna - tem seu próprio escritório, onde assiste "Family Guy".
A LaDonna trabalha como voluntária no Banco de Alimentos da Comunidade North County, na igreja mórmon a que pertence e, por telefone, aconselha pessoas recém-diagnosticadas com LMC para a Sociedade de Leucemia e Linfoma. Um de seus maiores desafios nos dias de hoje, ela disse, é convencer os pacientes a continuarem tomando o Gleevec; eles não suportaram os sintomas da CML fulminante e alguns acham irritantes os efeitos colaterais da droga.
O Gleevec manteve a LMC da LaDonna por sete anos, quando a doença se tornou resistente à droga. Felizmente, cientistas médicos e empresas farmacêuticas desenvolveram duas novas drogas CML, cada uma desativando a enzima BCR-ABL de uma maneira diferente e compensando um tipo de resistência Gleevec. Sprycel não ajudou LaDonna, mas Tasigna o fez - por cerca de dois anos. Agora ela está em seu quarto medicamento CML, o bosutinibe, que ainda é experimental. "Sua leucemia é a mais controlada desde quando eu cuidei dela nos últimos 11 anos", disse Druker.
Oncologia Personalizada
Sentado à pequena mesa de conferência redonda em seu pequeno escritório de esquina no alto de Marquam Hill, Druker disse que ainda estava estudando CML, esperando entender como eliminar todas as últimas células-tronco mutantes, e também estava tentando aplicar "o paradigma de Gleevec" outras leucemias. Uma camisa de corrida de bicicleta amarela brilhante usada e autografada pelo campeão do Tour de France e pelo sobrevivente de câncer Lance Armstrong estava pendurada na parede. Era um dia claro e a grande colherada de sorvete de baunilha do monte St. Helens era visível pela janela voltada para o norte, e o triângulo de contos de fadas do Monte Hood podia ser visto pela janela voltada para o leste. O cara que não tem o material certo para ser um professor assistente de Harvard é hoje o diretor do Knight Cancer Institute da OHSU, em homenagem a Phil Knight, fundador da Nike e nativo de Portland, e sua esposa, Penny, que em 2008 prometeram US $ 100 milhões para a instalação. "Brian Druker é nada menos que um gênio e um visionário", disse Phil Knight na época.
As honras foram derramadas, incluindo o prêmio máximo do campo, o Prêmio de Pesquisa Médica Clínica Lasker-DeBakey, que Druker compartilhou em 2009 com Lydon e Sawyers. De suas muitas aparições na mídia, nenhuma mudaria sua vida mais do que uma história sobre ele em People, The Miracle Worker, publicada em fevereiro de 2001. A revista havia enviado uma repórter chamada Alexandra Hardy para entrevistar o médico assassino de dragões. o hospital nas nuvens. Os dois se casaram em 2002 e são pais de Holden, Julia e Claire. Druker disse: “Agora tenho a capacidade de me concentrar na família como uma prioridade. Eu não poderia ter feito isso 10 ou 15 anos atrás.
Para alguns observadores, a fábula de Gleevec logo perdeu seu brilho. "'Droga Maravilha' para a Leucemia Sofre Retaliação", informou o Wall Street Journal em 2002, quando alguns pacientes se tornaram resistentes à droga ou não conseguiram tolerá-la. Além disso, parecia que os pesquisadores demoravam a produzir outras drogas para controlar outros tipos de câncer, questionando a promessa da estratégia. Um repórter da Time blogou em 2006 que o Gleevec era uma "droga da Cinderela" - um sapato de cristal que se encaixava em um candidato singular. Sawyers disse que se cansou de pesquisadores dizendo que o Gleevec era um tiro de sorte.
O custo da droga tem sido controverso desde o primeiro dia. O suprimento de um ano nos Estados Unidos agora gira em torno de US $ 50 mil, ou cerca de US $ 140 por comprimido diário. Isso é o dobro do custo original, que Vasella defendeu como "alta", mas também "justa", porque a droga proporciona aos pacientes uma boa qualidade de vida e a receita da empresa financia pesquisas sobre outras drogas. (Questionada sobre as razões para o aumento de preço, uma porta-voz da Novartis se recusou a comentar). Em qualquer caso, uma droga que a Novartis recuou em desenvolver porque o mercado era muito pequeno agora é um blockbuster. Em 2010, o Gleevec gerou US $ 4, 3 bilhões em vendas em todo o mundo - o segundo medicamento de maior bilheteria da empresa. Para ter certeza, a Novartis forneceu medicamentos gratuitos ou com descontos para pacientes de baixa renda. Em 2010, a empresa auxiliou cerca de 5.000 pacientes dos EUA doando-lhes US $ 130 milhões em medicamentos como Gleevec e Tasigna, também da Novartis.
Mas pacientes, médicos e outros reclamam há muito tempo do preço do Gleevec. Em seu livro de 2004, A verdade sobre as empresas farmacêuticas, Marcia Angell, ex-editora do New England Journal of Medicine, sugeriu que a Novartis estava "arrancando" pacientes no Gleevec. Recentemente, os médicos relataram que os pacientes pararam de tomar o Gleevec porque não podiam pagar, apesar do programa de assistência da empresa.
Druker, que disse que seu laboratório recebeu financiamento de pesquisa da Novartis, mas nem ele nem OHSU receberam royalties da Gleevec, deplora o custo. "Deve ser um preço acessível, que seria de US $ 6.000 a US $ 8.000 por ano", ele me disse. "A empresa ainda teria muitos lucros." Ele continuou: "Muitas drogas contra o câncer estão agora com preços bem fora do alcance da acessibilidade. Como uma indústria de saúde, vamos ter que enfrentar e lidar com isso. ”
Haverá muito o que lidar: parece que Gleevec não foi apenas um tiro de sorte. Apenas o fato de que os cientistas rapidamente projetaram novas drogas para lidar com a resistência de Gleevec mostra que eles cada vez mais sabem o que estão fazendo, disse Sawyers, agora no Memorial Sloan-Kettering Cancer Center. Ele liderou um grupo que foi o primeiro a explicar a resistência e estava envolvido no desenvolvimento do Sprycel. "Por que estou tão otimista?", Ele disse. "Conhecemos o inimigo e sabemos como vencê-lo."
De fato, várias terapias de câncer direcionadas a enzimas ganharam aprovação do FDA no rastro do Gleevec, incluindo drogas contra formas particulares de câncer de pulmão e câncer de pâncreas. E os pesquisadores dizem que são encorajados por tratamentos bem ao longo de ensaios clínicos. Alguns pacientes com melanoma cuja doença é causada por uma mutação genética conhecida parecem se beneficiar muito de um medicamento experimental chamado PLX4032. Sawyers está estudando uma forma de câncer de próstata estimulado por um receptor de hormônio mutante, e ele disse que testes clínicos de uma droga (chamada MDV3100) direcionados contra ela são "excitantes". Uma análise da indústria farmacêutica estima que as companhias farmacêuticas estão atualmente desenvolvendo e testando quase 300 terapias direcionadas para o câncer molecular à la Gleevec.
Arul Chinnaiyan, um patologista especializado em câncer na University of Michigan Medical School, em Ann Arbor, é franco sobre a influência de Gleevec. "Estamos tentando franquear seu sucesso", disse ele sobre suas tentativas de aplicar a abordagem da terapia direcionada a tumores sólidos, que são mais complexos que a LMC. Cada tipo de tumor sólido pode ser dirigido por múltiplas enzimas e receptores errantes - estruturas de proteínas que transmitem mensagens químicas - e a variedade de mutações pode variar de pessoa para pessoa. O próprio Chinnaiyan descobriu duas diferentes fusões gênicas mutantes, análogas às do BCR-ABL, que parecem conduzir a muitos cânceres de próstata. "O pensamento é que, se sabemos que estas são as lesões moleculares, poderemos combinar a droga ou combinação de drogas de forma adequada", disse Chinnaiyan.
Eu tenho uma noção do que ele chama de "oncologia personalizada" um dia em um pub de cerveja em Ann Arbor. Do outro lado da mesa de madeira cheia de cicatrizes, comendo um cheeseburguer com bacon e bebendo cerveja estava Jerry Mayfield, 62 anos, ex-policial estadual da Louisiana. Diagnosticado com CML em 1999, Mayfield foi informado na época por seu hematologista que ele tinha dois ou três anos de vida. Mayfield perguntou se havia drogas experimentais a considerar. O médico disse que não. Mayfield verificou a Internet, aprendeu sobre o STI571 e, tendo aprendido sozinho programação de computadores enquanto ocupava o balcão noturno na sede da polícia em Monroe, criou um site, o newcmldrug.com, para informar outros pacientes. Se ele tivesse escutado o médico de sua cidade natal, Mayfield disse: "sem dúvida eu não estaria aqui hoje".
Ele ainda administra seu site e atualmente mora em Bloomington, Illinois. Ele estava em Ann Arbor para ver Talpaz, que havia colaborado nos testes clínicos iniciais do Gleevec em Houston, mas havia se mudado para a Universidade de Michigan. Ele cuidou de Mayfield por mais de uma década, administrando terapias direcionadas em sucessão, pois Mayfield se tornou resistente ou não poderia mais tolerá-las: Gleevec, Sprycel, Tasigna, bosutinib e agora ponatinibe, mais uma droga CML experimental bloqueadora de quinase através de ensaios clínicos. ensaios.
Mayfield é “um garoto propaganda da terapia CML”, disse Talpaz. "Ele está indo muito bem."
Sobre a música barulhenta do pub Mayfield disse sobre seu gene BCR-ABL: "Eu tinha a mutação G250E - tenho a mutação G250E - e é por isso que me tornei resistente ao Gleevec".
Sua observação soava como algo saído de uma máquina do tempo programada para anos ou décadas a partir de agora, quando as pessoas vão falar indiferentemente sobre suas mutações genéticas mortais e as drogas que os impedem. É uma imagem que Druker costuma evocar. "Num futuro não muito distante", escreveu ele ao aceitar o Lasker-DeBakey Award, "os médicos serão capazes de analisar minuciosamente os tumores dos indivíduos quanto a defeitos moleculares e combinar cada pessoa com terapias específicas e eficazes que produzirão uma resposta durável com toxicidade mínima ”.
Mayfield nunca foi tratado por Druker, mas o consultou. "Eu estava no escritório do oncologista local um dia, dez anos atrás, e meu celular tocou", disse Mayfield. “Foi o Dr. Druker. Eu mandei um e-mail para ele. Eu fiquei chocado. Eu disse ao meu oncologista: "É rude responder a essa ligação, mas esse é meu herói". Ele é um homem tão gentil e gentil e dedicado, nem um pouco arrogante. Ele salvou muitas vidas. Todos no país devem saber o nome dele. Ele é o tipo de ídolo que deveríamos ter, em vez de estrelas do esporte ”.
O site de Mayfield tem um “álbum de agradecimento” dedicado a Druker, repleto de homenagens de pacientes com LMC. Instantâneo após instantâneo mostra pessoas sorrindo sob a luz do sol - caminhando, plantando árvores, bebendo champanhe - pessoas que se sentiam comovidas para dizer que lhe deviam, bem, tudo . Eles enviaram dezenas de poemas e limericks, como este de uma paciente chamada Jane Graham:
Era uma vez um médico chamado Brian
Em cuja pesquisa todos nós estávamos confiando
Ele sabia que estávamos doentes
Então ele nos fez uma pílula
E agora não estamos planejando morrer.
Contrário às Expectativas
Druker se encontrou com LaDonna Lopossa na sala de exames, onde ele vê os pacientes do estudo todas as quintas-feiras. George, que diz que LaDonna tem uma "qualidade de Molly Brown inafundável", a havia derrubado do Campo de Batalha para seu check-up. Ela se sentou em uma cadeira enquanto Druker, vestindo um terno azul escuro folgado, se encostou na borda de uma mesa de exame. "Eu não estaria aqui sem você", disse LaDonna (possivelmente para meu benefício).
"Bem, você está aqui", disse Druker. "Você está indo bem."
"Eu estou dançando bem nas ruas."
"Ótimo. Quaisquer problemas?"
"Não. Eu só tenho uma erupção cutânea.
"Quando isso começou?"
"Cerca de dez semanas atrás."
Ele perguntou sobre a erupção, e depois eu sairia do quarto para que ele pudesse examiná-la.
"Você ainda está trabalhando no banco de alimentos?", Ele perguntou.
"Eu estou fazendo um dia por semana."
"Como vai isso?"
"Formidável."
"Como está sua energia?"
“Minha energia é baixa. Mas meu cérebro está ativo.
"Você está apenas fazendo espetacularmente, em termos de leucemia."
"Eu sei isso. Eu posso sentir isso."
"O quê mais? Perguntas para mim?
"Eu estou indo em uma viagem amanhã."
"Para?"
"San Diego e Knott's Berry Farm com todos os meus netos." Ela atualizou seu progresso, e Druker recitou suas idades, como se para verificar se ele tinha os fatos certos. Quando ele se dirige a cientistas em conferências profissionais, ele frequentemente mostra fotografias de LaDonna e seus netos. Ao contrário de todas as expectativas, ele diz que ela está vendo seus bisnetos crescerem.
"Eu tenho uma vida tão maravilhosa", disse LaDonna, rasgando. “E eu não queria isso. Eu disse aos meus médicos: 'Não faça mais nada comigo.' "
Enxugando os olhos com um lenço de papel, ela mencionou sua primeira visita à clínica, em 2000, quando mal conseguiu atravessar a porta. "Isso foi há muito tempo", ela disse para ninguém em particular.
Então, para Druker, ela disse: "Mas foi rápido, não foi?"
"Não é?", Ele disse.
Terence Monmaney escreveu pela primeira vez para o Smithsonian em 1985. Ele é o editor executivo. Robbie McClaran, de Portland, fotografou sua cidade natal para a edição de novembro de 2010.








 LaDonna Lapossa faz uma pose no cemitério em 2000. (Cortesia Ladonna Lapossa)
LaDonna Lapossa faz uma pose no cemitério em 2000. (Cortesia Ladonna Lapossa)  "Estamos apenas vendo o começo de combinar pacientes com a droga certa e ver melhorias rápidas", diz o Dr. Brian Druker. (Robbie McClaran)
"Estamos apenas vendo o começo de combinar pacientes com a droga certa e ver melhorias rápidas", diz o Dr. Brian Druker. (Robbie McClaran)  Diagnosticado com leucemia em 1999, Jerry Mayfield, em sua casa em Bloomington, Illinois, foi informado de que tinha de dois a três anos para viver. "Eu estava esperando para ver o milênio", diz o ex-policial estadual, que criou um site sobre uma nova terapia que ele começou a tomar. (Tim Klein)
Diagnosticado com leucemia em 1999, Jerry Mayfield, em sua casa em Bloomington, Illinois, foi informado de que tinha de dois a três anos para viver. "Eu estava esperando para ver o milênio", diz o ex-policial estadual, que criou um site sobre uma nova terapia que ele começou a tomar. (Tim Klein)  Gravemente doente com leucemia, Suzan McNamara começou a tomar o medicamento Gleevec em 2000. Dez anos depois, ela se casou no Havaí. (Cortesia Suzan McNamara)
Gravemente doente com leucemia, Suzan McNamara começou a tomar o medicamento Gleevec em 2000. Dez anos depois, ela se casou no Havaí. (Cortesia Suzan McNamara)  "Este é um momento muito emocionante para a pesquisa do câncer", diz Arul Chinnaiyan (aqui, em seu laboratório na Universidade de Michigan), inspirado pelo sucesso de Gleevec. "Eu sou muito otimista tecnologia é o ponto onde podemos encontrar as origens genéticas de diferentes tipos de câncer." (Fabrizio Costantini / Aurora Select)
"Este é um momento muito emocionante para a pesquisa do câncer", diz Arul Chinnaiyan (aqui, em seu laboratório na Universidade de Michigan), inspirado pelo sucesso de Gleevec. "Eu sou muito otimista tecnologia é o ponto onde podemos encontrar as origens genéticas de diferentes tipos de câncer." (Fabrizio Costantini / Aurora Select)  "Quando você quase morreu, teve uma perspectiva diferente da vida", diz Lopossa, em sua casa com o marido, George. "Você tem mais apreço pelo que temos." (Robbie McClaran)
"Quando você quase morreu, teve uma perspectiva diferente da vida", diz Lopossa, em sua casa com o marido, George. "Você tem mais apreço pelo que temos." (Robbie McClaran) 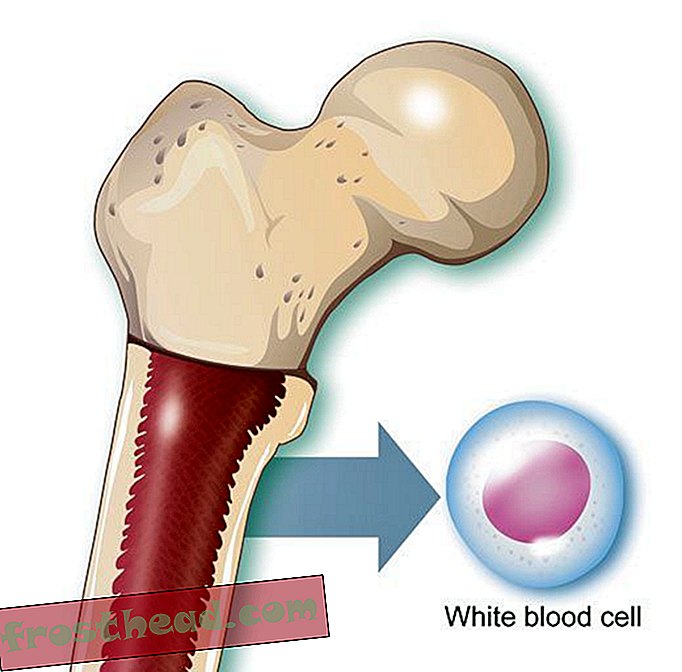 O que causa um câncer de sangue mortal? Na medula óssea, algumas células-tronco produzem glóbulos vermelhos portadores de oxigênio, enquanto outros criam glóbulos brancos, ou leucócitos, que geralmente curam ferimentos e combatem infecções. O pus de uma ferida infectada é tingido de branco em grande parte por leucócitos. (Ilustração para Smithsonian )
O que causa um câncer de sangue mortal? Na medula óssea, algumas células-tronco produzem glóbulos vermelhos portadores de oxigênio, enquanto outros criam glóbulos brancos, ou leucócitos, que geralmente curam ferimentos e combatem infecções. O pus de uma ferida infectada é tingido de branco em grande parte por leucócitos. (Ilustração para Smithsonian ) 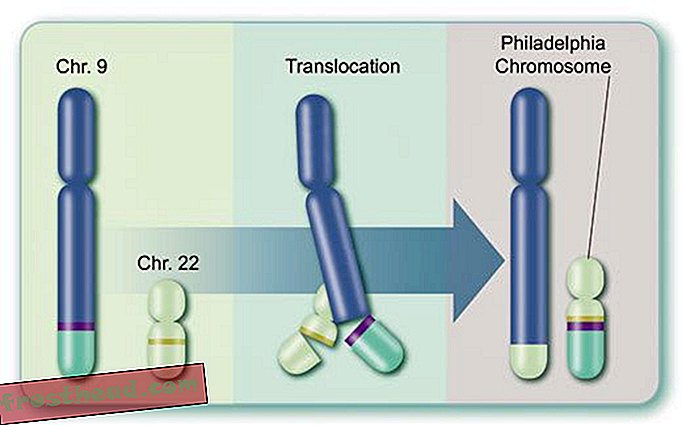 Cromossomos Caminhos Cruzados acidentalmente > A LMC surge quando uma célula-tronco erra durante a divisão. Em vez de os 23 pares de cromossomos serem duplicados com precisão, pedaços de cromossomos N ° 9 e N ° 22 trocam de lugar, criando um "cromossomo Filadélfia" aberrante com um gene mutante. (Ilustração para Smithsonian )
Cromossomos Caminhos Cruzados acidentalmente > A LMC surge quando uma célula-tronco erra durante a divisão. Em vez de os 23 pares de cromossomos serem duplicados com precisão, pedaços de cromossomos N ° 9 e N ° 22 trocam de lugar, criando um "cromossomo Filadélfia" aberrante com um gene mutante. (Ilustração para Smithsonian ) 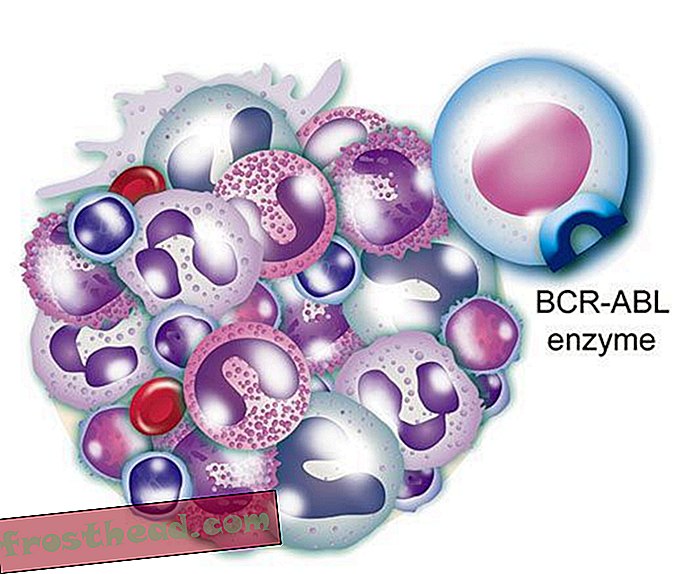 Uma droga que atinge o alvo O gene mutante fabrica uma enzima renegada de mesmo nome, BCR-ABL. Ela estimula a divisão de leucócitos ou leucemia. (Ilustração para Smithsonian )
Uma droga que atinge o alvo O gene mutante fabrica uma enzima renegada de mesmo nome, BCR-ABL. Ela estimula a divisão de leucócitos ou leucemia. (Ilustração para Smithsonian ) 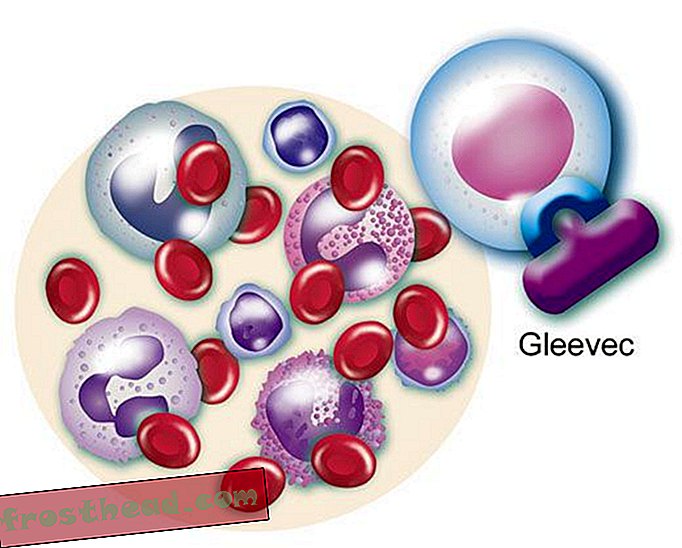 Uma droga que ataca o alvo A droga CLE, o Gleevec, bloqueia a enzima de bloqueio e chave dentro da célula, restaurando o crescimento normal das células brancas. (Ilustração para Smithsonian )
Uma droga que ataca o alvo A droga CLE, o Gleevec, bloqueia a enzima de bloqueio e chave dentro da célula, restaurando o crescimento normal das células brancas. (Ilustração para Smithsonian )