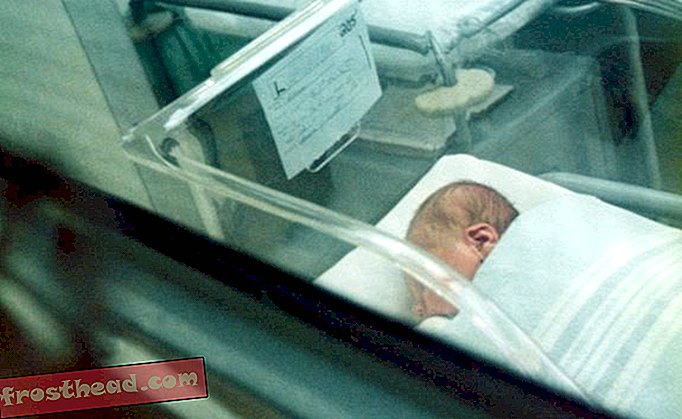
Três meses após o nascimento de Misty Lovelace, ela já estava ficando cega. Na primeira série, ela ainda conseguia ler letras pequenas, mas em poucos anos seus livros escolares eram encadernadores de páginas com impressão grande. Para percorrer corredores, ela memorizou o percurso ou dependia de um professor ou amigo. Sua visão era “como ter óculos escuros e olhar através de um túnel”, lembra ela. Na quinta série, alguém trouxe um planetário móvel para mostrar as luzes dos alunos representando as estrelas. Misty fingiu que podia vê-los.
Quando ela tinha 12 anos, os médicos determinaram que a cegueira de Misty tinha uma causa genética chamada amaurose congênita de Leber (LCA). Felizmente, uma equipe de marido e mulher da Universidade da Pensilvânia - Jean Bennett e Albert Maguire - estavam testando uma possível cura, e Misty viajou de Kentucky para participar do estudo. Um dia depois da cirurgia, os médicos tiraram o tapa-olho. “Eu vi uma explosão de cores. Tudo era muito mais brilhante ”, lembra ela. Pela primeira vez em anos, ela podia ver claramente o rosto de sua mãe, as rugas de sua avó, as costuras de tecido em seus bichinhos de pelúcia. Em casa, na piscina do quintal, uma noite, ela olhou para cima e começou a gritar. “Eu vejo essas pequenas luzes e elas estão todas piscando. Eu comecei a surtar ”, lembra ela. Sua mãe saiu correndo, pensando que o cloro estava machucando o olho tratado da filha. Misty finalmente pôde ver as estrelas.
O tratamento de Misty tornou-se disponível ao público durante o ano passado sob o nome Luxturna. Sua aprovação do FDA em dezembro de 2017 foi uma grande notícia - não apenas para os 1.000 a 2.000 americanos com LCA do tipo Misty, mas para pessoas com outras doenças genéticas que poderiam um dia ser curadas através da terapia genética.

Eu visitei Bennett e Maguire pela última vez há dez anos quando eles estavam tratando seus primeiros pacientes. Em julho passado, eles refletiram sobre sua jornada enquanto se sentavam em seu pátio no subúrbio de Bryn Mawr, na Filadélfia. Mercury, um cachorro Briard marrom e preto, ofegou no calor. Nascido cego, ele foi um dos primeiros sujeitos de pesquisa do casal. Sua mãe, Venus, outro cão anteriormente cego, estava ficando legal dentro de casa.
"Houve inúmeros obstáculos ao longo do caminho", disse Bennett, 63, enrolada em uma cadeira com seu café. Maguire, 58 anos, me deu um pote de mel de suas colméias. Ele me disse que sua esposa merecia crédito por ficar acordada até tarde trabalhando enquanto estava "roncando na cama".
Os dois se conheceram e se casaram na Harvard Medical School - Maguire estava se tornando cirurgião oftalmológico, e Bennett, que também tinha doutorado em biologia do desenvolvimento, estava prestes a entrar no novo campo da terapia genética. Trabalhando juntos, o par mostrou que eles poderiam melhorar a visão de ratos nascidos com cegueira genética. Em 2000, eles testaram isso em cães Briard que haviam nascido com cópias defeituosas do RPE65, o gene afetado pela LCA.
RPE65 é crucial para o ciclo visual em mamíferos. Quando a luz atinge pigmentos sensíveis na retina, ela lança uma série de reações que tornam a visão possível. Todo mundo tem breves momentos em que esse processo falha - por exemplo, depois que o olho é dominado por um flash da câmera. Em olhos saudáveis, esses momentos são fugazes. Mas as pessoas que têm duas cópias defeituosas do RPE65 não reagem adequadamente à luz. Com o tempo, as células sensíveis à luz - as hastes e cones - morrem, fazendo com que sua visão desapareça.
Trabalhando com os cães, os cientistas modificaram um vírus adeno-associado (um pequeno vírus inofensivo para os mamíferos), de modo que transportava DNA com RPE normal65. Então eles injetaram o vírus em um olho de cada filhote cego. Em poucos dias, os cães assustados que esbarraram em objetos se transformaram em animais ativos e com visão.
Em 2007, era hora de testar o procedimento nas pessoas. A comunidade médica ainda estava se recuperando da morte do adolescente Jesse Gelsinger, em 1999, em um estudo de terapia genética não relacionado na Universidade Penn. Começar esta nova pesquisa foi arriscado. Mas Gelsinger tinha sido tratado de uma doença metabólica do fígado, e o olho tinha certas vantagens: era de fácil acesso, e apenas uma pequena área de tecido, não o órgão inteiro, precisava receber o gene. Além disso, os médicos poderiam tentar a terapia em um olho antes de passar para o segundo. (Eles não esperavam um problema com os pacientes que produzem anticorpos contra o vírus, já que os olhos estão amplamente protegidos da resposta imune do corpo.)
Maguire e Bennett, juntamente com o Hospital Infantil da Filadélfia (CHOP), começaram a testar uma dose baixa deste tratamento em três adultos jovens com mutações RPE65. Maguire injetou uma gota do tamanho de uma ervilha sob suas retinas contendo bilhões de vírus portadores de RPE65. A visão dos pacientes melhorou - eles podiam ler sinais e ver padrões em tapetes, e podiam ler mais linhas em um diagrama de olho. Um sábado em casa, Bennett examinava dados sobre a contração da pupila de um paciente e subiu correndo para despertar Maguire de uma soneca. "Ficamos emocionados", diz ela.
A partir daí, a equipe mostrou que eles poderiam tratar com sucesso os segundos olhos dos pacientes. O próximo passo foi buscar a aprovação do FDA. Em 2013, a equipe fundou a Spark Therapeutics, uma empresa de biotecnologia, para desenvolver e financiar um estudo maior no CHOP e na Universidade de Iowa e realizar outros trabalhos para obter a primeira aprovação dos EUA para tratamento de uma doença genética. "Não havia roteiro, e isso foi muito pesado", diz Katherine High, hematologista e pesquisadora de terapia genética que ajudou a liderar os testes no CHOP e se tornou presidente da Spark.
Várias crianças já receberam o Luxturna como parte de seu atendimento clínico. O tratamento é de US $ 850.000 para os dois olhos. "O custo me horroriza pessoalmente", admite Bennett. (Nem ela nem Maguire lucram financeiramente com a terapia.) High diz que o preço é alto porque "o sistema atual não é projetado para tratamentos de alto valor". Ela observa que remédios para uma doença como hemofilia custam até US $ 400.000. um ano durante toda a vida. "Espera-se que o sistema recompense as terapias que atingem seus efeitos através de um único tratamento, mas isso ainda não é o caso", diz High.
Não se sabe por quanto tempo os benefícios do Luxturna durarão, mas Maguire diz que pacientes tratados até 11 anos atrás ainda têm visão estável no segundo olho, que recebeu uma dose maior que a primeira. Muitos deles agora podem andar sem bengala e distinguir as cores. Aqueles no final mais jovem da faixa etária de 4 a 44 anos relatam o maior número de benefícios, uma vez que perderam menos células fotorreceptoras: crianças que não podiam brincar ao ar livre depois de escurecer ou andar de bicicleta sem ajuda, agora capaz de fazer essas coisas. Alguns dos adolescentes são elegíveis para as carteiras de motorista. Eles são capazes de jogar futebol do time do colégio e se juntar ao time de líderes de torcida. Sua vida social floresceu quando eles conseguiram ler os rostos dos amigos.
O casal realizou tudo isso enquanto criava três filhos, agora crescidos. Sua casa ainda está decorada com a arte das crianças, junto com as pinturas de vacas de Ma-guire. Sua filha mais velha, Sarah Maguire, tem 32 anos e é pesquisadora de pós-doutorado na Johns Hopkins, onde ela está aprimorando os genes dos mosquitos para fazê-los não gostar do cheiro dos humanos. Ela se lembra de uma infância bastante normal, apesar de ter pais “muito peculiares”. “Meu pai voltava para casa e começava a dançar com os cachorros como Pee-wee Herman”, ela diz. Quando ela trouxe a pesquisa de insetos para casa em uma visita no ano passado, Bennett ansiosamente equipou um banheiro com um umidificador e aquecedor para manter os insetos vivos.
Um dia desses, Bennett e Maguire esperam se aposentar e criar vacas, ovelhas ou plantações - "Berkshire bud", brinca Maguire. Por enquanto, eles trabalham duro no Centro de Terapias Avançadas de Retina e Ocular, ou CAROT, que Bennett fundou na Universidade da Pensilvânia em 2014. Quando eu visitei, os pesquisadores estavam criando vírus transportadores de genes para novos testes. A excitação era palpável: a Luxturna preparou o caminho para a FDA aprovar uma infinidade de tratamentos promissores, não apenas para os olhos, mas para outros órgãos e doenças que estão sendo estudados em outros lugares. “Não havia caminho antes”, diz Bennett, “e agora existe”.
Misty Lovelace tem agora 19 anos e sua visão é de cerca de 20/64 com óculos. Quando o sol está brilhando, ela diz: "Eu posso fazer qualquer coisa". Ela espera em breve começar seus próprios cavalos de treinamento de negócios. "Eu não posso acreditar que fui eu", diz ela, olhando para trás em seu papel no estudo de Bennett e Maguire. “É só, uau, como se estivesse na loteria. Eles fizeram isso. Eles abriram as portas para todos.

Assine a revista Smithsonian agora por apenas $ 12
Este artigo é uma seleção da edição de dezembro da revista Smithsonian
Comprar