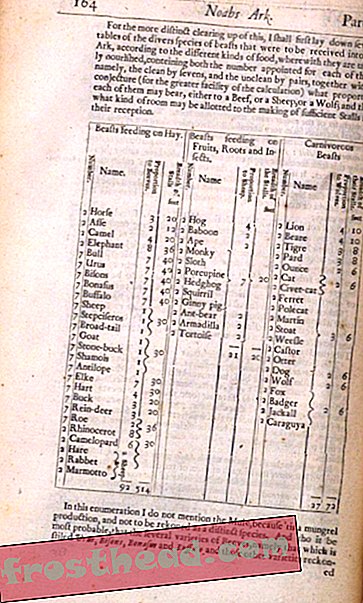
Por mais de 20 anos, a bióloga marinha Mary Hagedorn enfrentou um problema aparentemente intratável. Ela estava procurando uma maneira de congelar e descongelar os embriões do peixe-zebra.
Um importante animal experimental, os genes do peixe-zebra aproximam-se dos humanos o suficiente para serem usados para investigar doenças como a distrofia muscular e o melanoma. Se o material reprodutivo pudesse ser prontamente congelado e descongelado, esses estudos seriam mais fáceis de serem realizados e replicados, uma vez que os pesquisadores não teriam que trabalhar em torno dos cronogramas de desova ou lutar contra a deriva genética.
O problema se resume à maneira como os peixes se reproduzem. Os cientistas conseguiram congelar com sucesso - ou criopreservar, para usar o termo técnico - e descongelar espermas viáveis e óvulos de muitos animais por décadas. Mas os ovos de peixe se desenvolvem fora do corpo dos pais, o que apresenta desafios fisiológicos que não surgem quando se trabalha com células de gado, ou mesmo com humanos. O óvulo contém os nutrientes que o embrião em desenvolvimento precisará e também tem sua própria armadura, o que significa que esses ovos são grandes e muitas vezes encapsulados em uma membrana relativamente impermeável.
Para simplificar, os ovos de peixe tendem a ser grandes demais para congelar ou descongelar rapidamente em circunstâncias normais. Hagedorn - que trabalha como biólogo de pesquisa no Centro para a Sobrevivência de Espécies do Smithsonian National Zoo e Conservation Biology Institute - compara-os a planetas. Os ovos de mamíferos são tipicamente mais parecidos com os membros menores do nosso sistema solar - digamos, Mercúrio. Um ovo de peixe-zebra está mais perto de um gigante como Júpiter.
"Se você não congelar o tecido adequadamente, cristais de gelo se formarão nele e eles vão perfurar as células e destruí-los", diz Hagedorn.
Ela passou 12 anos em busca de uma solução alternativa, em última análise, estabelecendo uma nova solução que envolvia a microinjeção de um "crioprotetor" (um anticongelante, basicamente) nos óvulos, uma técnica que permitia que o agente contornasse a membrana protetora. Adequadamente calibrados para evitar o envenenamento das células, esses protetores poderiam ajudar a garantir que um ovo se vitrificasse uniformemente (tornando-se semelhante a um vidro) quando fosse mergulhado em um banho de nitrogênio líquido.
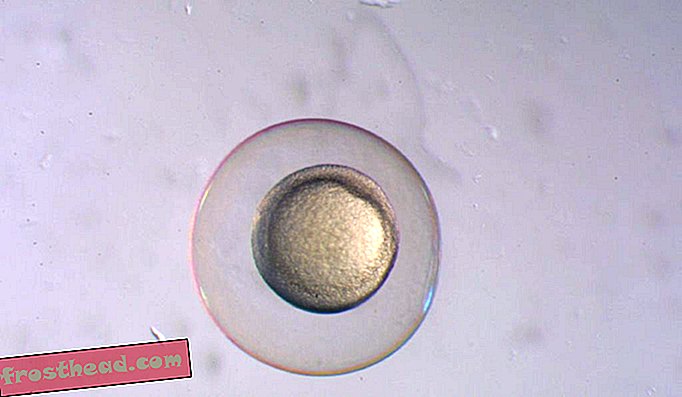 "Se você não congelar o tecido adequadamente, cristais de gelo se formarão nele e eles vão perfurar as células e destruí-los", diz Mary Hagedorn do problema que ela enfrentou tentando congelar embriões de peixe-zebra. (Enciclopédia da Vida / Bioimages)
"Se você não congelar o tecido adequadamente, cristais de gelo se formarão nele e eles vão perfurar as células e destruí-los", diz Mary Hagedorn do problema que ela enfrentou tentando congelar embriões de peixe-zebra. (Enciclopédia da Vida / Bioimages) Embora esse processo pudesse efetivamente colocar os embriões de peixes em um estado de animação suspensa, aquecê-los novamente tornou-se um problema. Enquanto aquecem, há um ponto intermediário entre o estado ideal em forma de vidro e a temperatura ambiente, onde os cristais de gelo podem começar a se formar novamente. E esses cristais podem danificar o material celular, deixando-o incapaz de mais desenvolvimento.
"Precisávamos descongelá-los muito mais rápido", disse Hagedorn. “Usando as ferramentas que tivemos em 2011. . . Eu bati em uma parede.
Por um momento ela desistiu.
E é assim que as coisas poderiam ter ficado se não fosse por um encontro casual em uma conferência de criopreservação em algum momento de 2013, onde ela ouviu uma apresentação de John Bischof, professor de engenharia mecânica na Universidade de Minnesota.
Como diz Bischof, ele estava apresentando um tópico não relacionado envolvendo nanopartículas de óxido de ferro, que seu laboratório usou no reaquecimento seguro de tecido humano para transplante. Sua pesquisa clicou com Hagedorn, levando-a a pensar em seu potencial para aplicações não-mamíferas.
"Ela disse: O que você pode fazer para me ajudar com os embriões", lembra Bischof.
Essa pergunta inicial deu origem a uma colaboração interdisciplinar complexa e contínua - na qual Hagedorn e Bischof insistem na importância do trabalho do outro.
Seus resultados, publicados esta semana na revista ACS Nano, indicam que pode ser possível reaquecer embriões de peixes congelados com segurança, afinal.
A inspiração para o seu trabalho veio dos esforços de um cientista Peter Mazur, que já faleceu, e achou que seria possível reaquecer embriões congelados com lasers. (Sim, lasers.) Embora a ideia fosse potencialmente sólida, é desafiador, disse-me Hagedorn, fazer com que os lasers transmitissem calor a material biológico. Juntamente com outro pesquisador chamado Fritz Kleinhans, no entanto, Mazur descobriu que seria possível introduzir outra substância na solução com o embrião, uma que captasse o calor do laser e o transferisse para a matéria biológica.
No caso de Mazur, isso significava negro de fumo na forma de nanquim, uma substância que absorve e transmite bem o calor - e que, segundo Kleinhans, você pode simplesmente comprar na Amazon.com. Se fosse colocado ao redor de um embrião de camundongo congelado, por exemplo, um único pulso de laser poderia quase instantaneamente levar o material celular à temperatura ambiente, evitando a fase intermediária do aquecimento, onde cristais de gelo ameaçam se formar. Kleinhans diz que durante a fase inicial do trabalho de Hagedorn, ela esperava que a técnica pudesse funcionar também para embriões de peixe-zebra. Infelizmente, eles ainda eram muito grandes e, quando o calor exterior chegou ao centro, cristais de gelo fatais já estavam se formando.
Como Hagedorn, Bischof e seus colaboradores escrevem em seu novo artigo, entretanto, havia outro caminho. Espalhar tinta da Índia do lado de fora do embrião pode não ter sido suficiente, mas e se eles inserissem algum outro material responsivo antes de congelar? Para fazer isso, eles se estabeleceram em nanobastões de ouro - estruturas moleculares minúsculas, ordens de magnitude menores que um cabelo humano - que eles microinjetam junto com agentes anticongelantes no embrião antes da preservação, empregando os métodos que Hagedorn havia desenvolvido anos antes.
Como os pesquisadores escrevem em seu artigo, “Essas nanopartículas podem efetivamente gerar calor quando o comprimento de onda do laser coincide com a energia de ressonância plasmônica da superfície das nanopartículas de ouro”. Essa é uma maneira complicada de dizer que os nanobastões poderiam absorver e amplificar a energia de um breve flash de luz.
O ouro, como muitas outras substâncias, exibe propriedades diferentes na nanoescala do que a granel. Um pulso de laser de milissegundo bem calibrado pode repentinamente aquecer um embrião por meio do ouro distribuído por ele, reaquecendo-o a uma taxa espantosa de 1, 4 x 10 7 ° C por minuto, uma temperatura quase insondável que é gerenciável nas rajadas rápidas que os pesquisadores empregam.
"Nesse pulso de um milissegundo do laser, você vai do nitrogênio líquido à temperatura ambiente", diz Bischof. Significativamente, ao contrário de qualquer método que Hagedorn tivesse tentado antes, os resultados eram suficientemente quentes - e amplamente distribuídos - para reaquecer com sucesso todo um embrião de peixe-zebra de uma só vez.
Com essa barreira finalmente cruzada, as questões permaneceram. A chave entre eles era se esses embriões ainda seriam viáveis. Como os pesquisadores relatam em seu artigo, uma parcela significativa foi, embora não todos. Daqueles que descongelaram, 31% fizeram apenas uma hora após o aquecimento, 17% cruzaram a marca de três horas e apenas 10% ainda estavam se desenvolvendo após a marca de 24 horas.
Embora isso possa parecer pequeno, é muito maior do que a taxa de sobrevivência de zero por cento que os métodos anteriores haviam gerado. Hagedorn espera que o trabalho futuro “melhore” ainda mais esses números. E ela continua positiva até mesmo com o valor de 10%. "Um peixe pode produzir milhões de ovos, e se eu conseguir congelar com sucesso 10% deles, esse é um número muito bom", diz ela.
É claro que lidar com milhões de ovos exigiria que eles transformassem ainda mais o processo de eficiência. Neste ponto, grande parte desse trabalho recai sobre os ombros de Bischof e outros em seu laboratório, onde o trabalho já está em andamento para melhorar o “throughput” do processo, potencialmente tornando-o um empreendimento mais industrial. “Eu acho que haverá uma série de tecnologias capacitadoras que serão desenvolvidas para isso nos próximos anos”, ele me disse.
Se esse trabalho for bem-sucedido, Hagedorn acha que pode ter outros usos que vão muito além do humilde peixe-zebra.
“Muitos produtores de aquicultura querem congelar peixes [material reprodutivo], porque eles só desovam uma vez por ano”, disse ela. “Você tem esse aspecto de boom e busto em administrar suas fazendas. Se você pudesse tirar os embriões do freezer de uma maneira mais regular, isso tornaria os alimentos mais baratos e confiáveis ”.
Pode também ter um impacto na conservação da vida selvagem. Hagedorn, que trabalha principalmente com corais hoje, acha que pode nos ajudar a consertar os recifes danificados. Ela também sugere que poderia restaurar populações de rãs esgotadas, e talvez salvar outras espécies também. Independentemente de onde o trabalho nos leva no futuro, no entanto, ele é uma prova do potencial da colaboração científica hoje.
“No começo, honestamente, não parecia real. Faz sentido biológico que pudéssemos fazê-lo, mas parecia que nunca conseguiríamos juntar todas as peças ”, ela me disse. “Se eu não tivesse me sentado ao lado de John naquela reunião, nunca teríamos feito isso. Sem nossos esforços conjuntos - a engenharia e a biologia - isso não teria acontecido ”.